Некоторые особенности секреции пролактина у больных с паническими атаками различной тяжести
Хасанова Д.Р., Ваганова Г.Р., Житкова Ю.В., Абдулхаев Ф.А., Анцилевич Л.М., Сатарова Л.И.
Межрегиональный клинико-диагностический центр, г.Казань, Казанский государственный медицинский университет, Казанская государственная медицинская академия
Реферат. Изучены уровень секреции пролактина у больных с паническими атаками различной тяжести и его динамика на фоне лечения. В ходе пробы с L-ДОФА в группе больных выявлена относительная гиперпролактинемия, зависящая от тяжести заболевания. На фоне лечения флуоксетином показатели секреции пролактина нормализовались. Выявлена недостаточность дофаминергической системы у больных с паническими атаками, более выраженная при тяжелых клинических формах заболевания, нивелируемая на фоне лечения флуоксетином. Это указывает на общность патологических интеграции серотониновой и дофаминовой нейромодуляторной систем у больных с паническими атаками.
Проблемам структурно-функциональной организации нейроэндокринной системы посвящено множество научных работ последних лет [3, 13, 14, 16, 20]. По современным представлениям, вершиной нейроэндокринной иерархии является ЦНС, регулирующая и интегрирующая процессы адаптации и поддержания гомеостаза, в частности его вегетативных показателей [3, 8, 9]. Регуляторные центры анатомически объединены в лимбическую систему, которая посредством многочисленных замкнутых нейрональных кругов организует целостные поведенческие акты и формирует вегетосоматические взаимоотношения.
Центр лимбической системы - гипоталамус - опосредует влияния супрагипоталамических центров на гипофиз и служит ведущим звеном нейроэндокринной регуляции [2,4,5,11,12,14, 18]. Чрезвычайная сложность и многообразие функций лимбической системы объясняются организацией межнейрональных связей. Открытия нейрокринии, спиловера, диффузной внесинаптической нейропередачи и феномена нейрональной пластичности значительно расширили знания о "способах общения" ближайших и отдаленных нейронов между собой и сформировали представление о работе нейрональных сетей, динамически связавших различные структуры мозга в единое целое [1, 15, 19, 21, 22, 23, 24, 25].
Биохимическим субстратом межнейронального взаимодействия являются нейромодуляторы, главным образом моноамины. Теория моноаминовых нарушений легла в основу патогенеза многих заболеваний, в том числе психовегетативного синдрома с клиникой панических атак (ПА) [7, 8, 10, 16, 18].
Чрезвычайная распространенность и социальная патогенность психовегетативного синдрома объясняют интерес к изучению нейрохимических систем, ответственных за его реализацию. Особое значение придается взаимоотношению серотониновой (СТ) и дофаминовой (ДА) систем [3, 8, 10]. В лечении ПА перспективными считаются антидепрессанты группы селективных ингибиторов обратного захвата серотонина (СИОЗС) [6,17]. Интегративные взаимоотношения СТ и ДА систем определяются, во-первых, структурно-функциональной гетерогенностью рецепторов, во-вторых, тем, что при эмоциональном стрессе меняется химическая чувствительность нейронов различных отделов мозга к нейромедиаторам [3, 16]. В этой связи представляет интерес оценка влияния терапии антидепрессантами группы СИОЗС на функциональное состояние ДА системы. Непосредственным отражением моноамино-пептидных взаимоотношений служит уровень гипофизарных гормонов в крови [12, 13, 14, 18]. Наибольший интерес представляет пролактин (ПРЛ), так как его инкреция полностью подчинена гипоталамусу и регулируется только центральными механизмами, среди которых доминирует тонический тормозящий дофаминовый контроль. Кроме того, базальный уровень ПРЛ не претерпевает резких изменений в период менструального цикла и в менопаузе, а также не имеет существенных половых различий [11, 12, 14]. Благодаря твердо установленным реципрокным секреторным взаимоотношениям с ДА, базальный уровень ПРЛ плазмы крови, исследованный в условиях, исключающих возмущающие, стимулирующие секрецию ПРЛ воздействия, может служить показателем состояния ДА системы.
Целью работы являлось изучение секреции ПРЛ и его динамики на фоне лечения у больных с паническими атаками различной тяжести.
Было обследовано 67 больных (13 мужчин и 54 женщины) от 19 до 56 лет с ПА, являющимися на момент обследования клинически актуальными. Больных отбирали согласно критериям ПА DSM-IV и МКБ-10. Степень тяжести ПА оценивали как легкую, среднюю и тяжелую [6]. У 50% больных были высокая частота развития приступов, выраженные коморбидные расстройства (агорафобия, депрессия, генерализованная тревога), что соответствовало ПА тяжелой степени. Больные со средней и легкой степенью ПА составляли соответственно 23% и 26% от общего числа больных. У них возникало не более 4 атак в месяц, характеризующихся мягкими или средней выраженности клиническими симптомами.
В контрольную группу вошли 32 здоровых добровольца - 21 женщина и 11 мужчин от 18 до 55 лет, которые соответствовали критериям здоровья, приведенным в Уставе ВОЗ (1948 г.).
У всех обследованных исключали патологические состояния, сопровождавшиеся гиперпролактинемией: гипотиреоз, гинекологическую патологию (прежде всего эндометриоз и склерополикистоз яичников). Для этого всех консультировал эндокринолог, а женщин, кроме того, на догоспитальном этапе осматривал гинеколог с проведением соответствующих методов обследования. Исключался прием каких-либо медикаментов, особенно влияющих на секрецию ПРЛ (антидепрессанты, оральные контрацептивы, метоклопрамид, мотилиум). Для исключения органической патологии, прежде всего эндоселлярного объемного процесса, проводилась нейровизуализация - МРТ головного мозга с контрастным усилением.
Лица с какими-либо признаками нарушения биологических эффектов гормонов обследованию не подлежали. Все пациенты прошли также общепринятое клинико-неврологическое обследование с оценкой микроорганического фона.
Функциональное состояние нейроэндокринной системы определяли путем исследования уровня ПРЛ в плазме крови с помощью стандартной нагрузочной пробы с L-ДОФА, так как изучение работы всякой динамической системы требует применения нагрузочных проб [14]. В качестве донатора дофамина использовался препарат дуэллин (EGIS, Венгрия), содержащий 250 мг леводопы и 25 мг карбидопы. Начиная с полуночи перед днем исследования обследованные не принимали пищу. В течение всей процедуры они находились в постели, не курили, но им разрешалось посещать туалет. Исследование проводилось с учетом физиологического ритма секреции ПРЛ, в стандартные утренние часы (начиная с 9 часов утра). Чтобы исключить влияние венепункции на секрецию ПРЛ, взятие крови производилось через постоянный катетер, который промывали раствором 0,9% натрия хлорида. Базальный уровень секреции ПРЛ определяли двукратно в 5 мл венозной крови с интервалом в 30 минут. Затем, через час после приема внутрь одной таблетки дуэллина у обследованных через каждые 30 минут брали пробы венозной крови для определения уровня ПРЛ в плазме крови методом ИФА по стандартной методике.
У 20 больных с ПА различной тяжести был проведен контроль базальной секреции и динамики значений ПРЛ в ходе нагрузочной пробы с L-ДОФА на фоне лечения флуоксетином (ланнахер), антидепрессантом группы СИОЗС через 4 недели ежедневного приема препарата по 20 мг на ночь (на высоте лечебной дозы).
Статистическую обработку полученных результатов производили на персональном компьютере Intel Pentium II по программам, разработанным в пакете SPSS 10,0, EXEL 2000, с использованием библиотеки статистических функций.
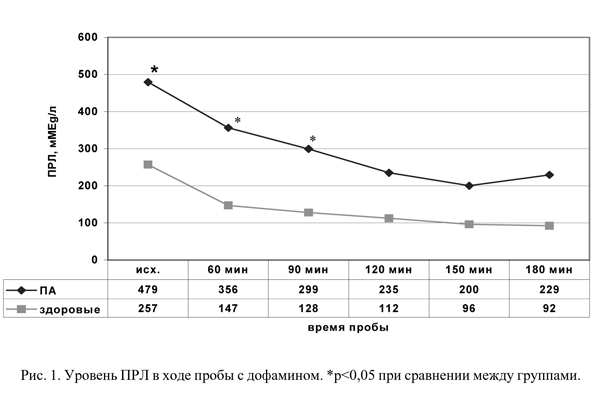
В ходе пробы с L-ДОФА у больных были выявлены относительно высокий уровень базальной секреции ПРЛ и относительная гиперпролактинемия в течение всей пробы (рис.1).
Следует подчеркнуть, что речь идет об относительно высоких цифрах ПРЛ, находящихся в пределах нормальных значений, с учетом половой принадлежности. Поскольку введение L-ДОФА не дает сколько-нибудь ясных сведений о способности гипоталамуса синтезировать ДА, так как декарбоксилаза передней доли гипофиза способна превращать L-ДОФА в ДА [14], полученные данные указывают на страдание ДА системы в целом, но не на уровень ее поражения.
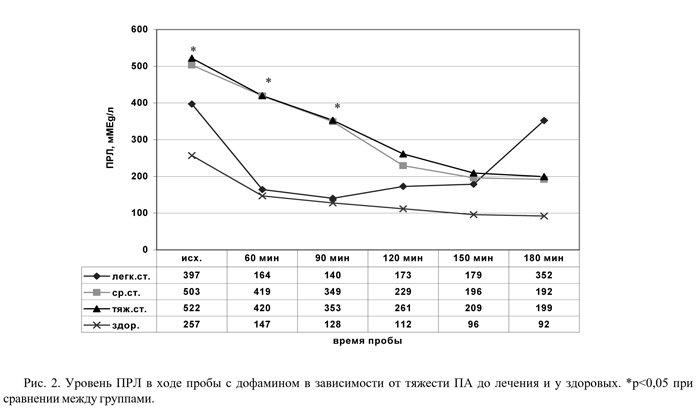
Установлена прямая зависимость уровня относительной гиперпролактинемии от тяжести клинических проявлений ПА. У больных с ПА тяжелой и средней степени выявлена достоверно более высокая базальная секреция ПРЛ, чем у здоровых - соответственно 522±11,4 мMEg/л (р<0,05), 503±28,5 мMEg/л (р<0,05) и 257±12,6 мMEg/л.
Уровень базальной секреции больных с ПА легкой степени занимал промежуточное положение между данными контроля и группы больных с тяжелыми формами ПА (397±15,3 мMEg/л). В начале пробы (через час после введения ДА) у всех больных и у здоровых отмечено достоверное снижение значений ПРЛ, максимальное у больных с ПА легкой степени. Обращает на себя внимание ригидность к влиянию дофамина у больных с тяжелыми формами ПА: относительная гиперпролактинемия прослеживалась на протяжении всей пробы по сравнению с контролем (рис.2). У больных с легкой степенью ПА повышение значений ПРЛ началось уже через 90 минут пробы, а через 150 минут отмечалось быстрое восстановление концентрации ПРЛ в плазме, достигавшее исходного уровня через 180 минут пробы (через 150 минут - 178,9±38,67 мMEg/л, через 180 минут - 351,6±20,03 мMEg/л; р<0,001). В других группах больных, а также в группе контроля резких колебаний значений ПРЛ в ходе пробы не было. Наибольшая реакция в пробе отмечалась у больных с легкими вариантами ПА, что приближало уровень ПРЛ у больных с ПА легкой степени к показателям группы контроля, отражая факт поддержания у них нейроэндокринного баланса в пределах нормы в начале пробы. Однако наблюдавшаяся уже с 90-й минуты тенденция к повышению и резкий подъем значений ПРЛ на 150-й минуте пробы у больных с ПА легкой степени указывали на несостоятельность и преждевременное истощение дофаминергической системы у больных даже с легкой формой ПА. Нечувствительность к ДА пациентов с тяжелыми ПА свидетельствует о грубом срыве нейрогуморальных адаптационных механизмов. Таким образом, в зависимости от тяжести течения ПА имеют свои особенности нейроэндокринного ответа, выявляемые только в ситуациях нагрузочного характера.
 |
Известно, что различные стрессорные воздействия, в том числе состояние тревоги и паники, вызывают повышение уровня ПРЛ в крови. При изучении влияния серотонина на секрецию ПРЛ было доказано, что те же эффекты наблюдаются и в случае стимуляции серотонинового пути, т.е. в этом отношении СТ выступает как антагонист ДА [15]. На фоне лечения флуоксетином уровень базальной секреции ПРЛ у больных с ПА вне зависимости от тяжести заболевания приближался к таковому у здоровых (рис.3).
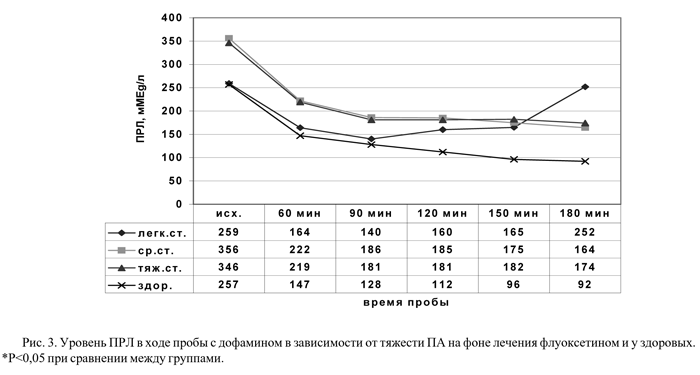 |
Наиболее выраженный лечебный эффект наблюдался у больных с ПА легкой степени: исходные показатели ПРЛ в этой группе на фоне терапии пришли к абсолютной норме (рис.3). У больных с ПА тяжелой и средней степени на фоне приема флуоксетина также уменьшилась гиперпролактинемия, наблюдаемая до лечения, однако показатели ПРЛ оставались более высокими, чем у здоровых, но без достоверной разницы. Профиль кривых ПРЛ в пробе независимо от тяжести ПА под влиянием лечения не менялся. Таким образом, у больных с ПА можно констатировать нормализацию уровня базальной секреции ПРЛ и динамики его значений в ходе пробы с L-ДОФА на фоне приема флуоксетина.
ВЫВОДЫ
1. Установлено снижение ДА влияний у больных с ПА, проявлявшееся субклинической, выявляемой только в нагрузочной пробе с L-ДОФА гиперпролактинемией.
2. У больных с ПА обнаружены различные типы реагирования ДА системы на нагрузку, оцениваемой по динамике значений ПРЛ в ходе пробы с L-ДОФА, ассоциирующиеся со степенью тяжести заболевания. Легкие варианты течения ПА отражают избыточную активацию центральных нейроэндокринных регуляторных механизмов, проявлявшуюся гиперреактивностью в нагрузочной пробе. Избыточная реакция в ответ на стимул быстро сменялась явлениями истощения механизмов регуляции и уменьшалась по мере нарастания тяжести заболевания. Тяжелые варианты ПА демонстрируют ареактивные, ригидные к стимулам формы реагирования. На этом основании можно констатировать функциональную недостаточность ДА звена нейроэндокринной регуляторной системы у больных с ПА легкой степени и ее грубом срыве у больных с тяжелыми формами ПА.
3. Установлено, что на фоне лечения флуоксетином (антидепрессант группы СИОЗС) у больных с ПА происходит нормализация секреции ПРЛ, обусловленная усилением эффектов дофамина, при сохранении типа реагирования в нагрузочной пробе с L-ДОФА. Это указывает на общность патологических интеграции серотонинергической и дофаминергической нейромодуляторных систем у больных с ПА.
Литература
1. Акмаев И.Г. Структурные основы механизмов гипоталамической регуляции эндокринных функций. - М., 1979.
2. Бадалян Л.О., Герасимова О.И., Герасимов Г.А. Актуальные проблемы эндокринологии: пептидергическая система мозга.- М, 1982.
3. Базян А.С. Нейромодуляторные интегративные механизмы формирования эмоционально-мотивационных состояний // Нейрохимия. - 1999. - № 2. - С.88-102.
4. Вейн A.M. Лекции по неврологии неспецифических систем мозга. - М., 1974.
5. Вейн A.M., Вознесенская Т.Г., Воробьева О.В. и др. Вегетативные расстройства. Клиника, диагностика, лечение. - М., 2003.
6. Вейн A.M., Дюкова Г.М., Воробьева О.В., Данилов А.Б. Панические атаки. - Спб., 1997.
7. Голубев В.П., Левин Я.И., Вейн A.M. Болезнь Паркинсона и синдром паркинсонизма. - М., 1999.
8. Горбунова А.В. // Нейрохимия. - 2000. - № 3. - С.163-184.
9. Гуревич К.Г. // Нейрохимия. - 2002. - № 2. - С.93-97.
10. Гуревич К.Г., Гордеева М.А., Подколзин А.А. // Нейрохимия. - 2001. - № 2. - С.104-106.
11. Дедов И.М. Болезни органов эндокринной системы / Руководство для врачей. - М., 2002.
12. Дедов И.И., Дедов В.И. Биоритмы гормонов.- М., 1992.
13. Зурнаджи Ю.Н. // Арх. Патол. - 1991. - № 1. - С.3-8.
14. Йен С.С.К., Джаффе Р.Б. Репродуктивная эндокринология. - М., 1998.
15. Кудряшова И.В. // Нейрохимия. - 2002. - № 2. - С.85-92.
16. Панченко Л.Ф., Фирстова Н.В., Митюшина Н.В., Генгин М.Т. // Нейрохимия. - 2000. - № 2. - С.83-92.
17. Раевский К.С. // Психиатрия и психофармакотерапия. - 2001. - № 5.
18. Теппермен Дж., Теппермен X. Физиология обмена веществ и эндокринной системы. - М., 1989.
19. Фрумкина Л.Е., ХаспековЛ.Г. // Нейрохимия. - 2003.- №3. - С.165-178.
20. Ханбабян М.В. Норадренергические механизмы мозга. - Л., 1981.
21. Lomo Т. // Philos. Trans. R. Soc. Long. В. Biol. Sci. - 2003. - Vol. 358(1432). - P.617-620.
22. Mitchell S.J. and Silver R.A. // Neuron. - 2003. - Vol. 38.- P. 433-445.
23. Rivera C., VoipioJ., Payne J.A., Ruusuvuori E., Lahtinen H., Lamsa K., Pirvola U., Saarma M., Kaila K. // Nature. - 1999. - Vol. 397(6716). - P.251-255.
24. Rusakov D.A., Kullmann D.M., Stewart M.G. // Trends Neurosci. - 1999. - Vol. 22(9). - P.382-388.
25. Semyanov A., Walker M.C., Kullmann D.M. // Nature Neurosci. - 2003. - Vol. 6(5). - P.484-490.
Хасанова Д.Р., Ваганова Г.Р., Житкова Ю.В., Абдулхаев Ф.А., Анцилевич Л.М., Сатарова Л.И. Некоторые особенности секреции пролактина у больных с паническими атаками различной тяжести // Неврологический вестник. - 2004. - Т. XXXVI, вып. 1-2. - С.53-58.