Клинические и иммуно-логические признаки диффузных заболеваний соединительной ткани у больных рассеянным склерозом
Султанова И.В., Коликова Ю.О., Ишмухаметова Д.Г., Матвеева Т.В., Арлеевская М.И.
Казанский государственный медицинский университет,
Казанский государственный университет,
Центральная научно-исследовательская лаборатория Казанской государственной медицинской академии
Реферат. Обнаруживаемые при рассеянном склерозе нарушения функционирования иммунной системы во многом схожи с дефектами при ряде классических аутоиммунных заболеваний. У больных рассеянным склерозом выявлены клинические признаки, близкие к таковым при диффузных заболеваниях соединительной ткани, в частности при системной склеродермии. Исследован уровень сывороточных аутоантител к нативной и денатурированной ДНК при рассеянном склерозе и системной склеродермии. Обнаружена ассоциация повышенного содержания аутоантител к ДНК с I стадией рассеянного склероза. Полученные данные свидетельствуют об общности патогенеза рассеянного склероза и аутоиммунных заболеваний соединительной ткани на ранних этапах их возникновения с дальнейшим расхождением путей развития.
Обнаруживаемые при рассеянном склерозе (PC) изменения иммунологических показателей во многом схожи с таковыми при ряде классических аутоиммунных заболеваний [2]. Единичные работы свидетельствуют о наличии в крови при PC полиспецифичных ДНК-связывающих антител [1, 5, 6, 8].
Целью работы являлось выявление у больных PC внецеребральных клинических признаков нарушения функционирования иммунной системы в сравнении с таковыми у пациентов с системной склеродермией (ССД), исследование у них уровня сывороточных аутоантител (ААТ) к ДНК и сопоставление полученных результатов с фазами и стадиями патологического процесса.
Обследованы 43 пациента с достоверным диагнозом PC [7] цереброспинальной формы - 33 женщины и 10 мужчин в возрасте от 21 до 58 лет. Длительность заболевания варьировала от одного года до 16 лет. 27 пациентов находились в фазе обострения, 16 - в фазе ремиссии; у 11 больных наблюдалась I стадия заболевания, у 32 - II. Диагноз во всех случаях был подтвержден данными МРТ. Тяжесть состояния по шкале инвалидизации EDSS колебалась от 1,5 до 6 баллов.
Группу сравнения составили 12 пациенток с достоверной ССД [3]. У одной из них диагностировано подострое течение заболевания, у остальных - хроническое. I стадия ССД была у одной больной, II - у 5 и III - у 6. У 9 больных определялась I степень активности процесса, у 3 - II.
В качестве контроля были использовали образцы сыворотки крови, взятые у 21 здорового донора.
Клиническое обследование пациентов проводилось на предмет обнаружения у них внецеребральных признаков, характерных для аутоиммунных заболеваний соединительной ткани (ливедо, синдром Рейно и др.). Содержание ААТ к ДНК определяли методом твердофазного иммуноферментного анализа [4]. Антигеном служила нативная ДНК эритроцитов цыплят ("SERVA", ФРГ). Для денатурации ДНК инкубировали при 100°С 15 минут. Образцы сыворотки хранили при -20°С и непосредственно перед реакцией инкубировали при 56°С для инактивации белков системы комплемента. Полистироловые планшеты (НПО "Полимед", Санкт-Петербург) для иммунологического анализа предварительно облучали УФ-лучами в течение 2 часов. ДНК (10 мкг/мл) вносили в лунки планшета в количестве 100 мкл, инкубировали при комнатной температуре 16 часов. Несвязавшуюся с планшетом ДНК трижды отмывали фосфатно-солевым буфером, содержащим 0,05% Твин-20 (ФСБТ), рН 7,2. Анализируемые образцы сыворотки в разведении с ФСБТ 1:100 вносили по 100 мкл в лунку, инкубировали 1,5 часа при 37°С, затем 30 минут при 4°С. По окончании инкубации планшеты трижды промывали ФСБТ и вносили раствор конъюгата в ФСБТ. После инкубации с конъюгатом планшеты отмывали и ополаскивали дистиллированной водой. Субстратную смесь, содержащую 0,4 мкг/мл орто-фенилендиамина, вносили в лунки планшета и инкубировали 30 минут в темноте при комнатной температуре. Оптическую плотность измеряли при длине волны 492 нм на приборе "Мультискан" ("Flow", Великобритания). При обработке результатов использовали относительные единицы (отн. ед.), равные отношению оптических плотностей исследуемой сыворотки и стандарта. Стандартом служила положительно реагирующая сыворотка с высоким содержанием ААТ к ДНК. Статистическую обработку данных, полученных при анализе каждого образца, производили вычисляя из 4 повторов среднее арифметическое, ошибку среднего и коэффициент вариации. В работе использовались индивидуальные показатели ААТ к ДНК, в которых коэффициент вариации не превышал 10%. Различия в группах оценивали с помощью t-критерия Стьюдента и непараметрических ранговых критериев Краскелла-Уоллиса, Манна-Уитни и Вилкоксона.
18 пациентов с PC из 43 обследованных были осмотрены с целью выявления внецеребральных поражений, характерных для аутоиммунных заболеваний соединительной ткани. У 16 из них обнаружены клинические синдромы, свидетельствовавшие о дисфункции иммунной системы (табл. 1). Наиболее часто (в 61,1% случаев) у больных PC встречался инфекционный синдром - верифицированные специалистами хронические очаги инфекции в носоглотке, верхних дыхательных путях с частыми (от 3 до 10 раз в год) длительными (до 3 недель и более) обострениями, частые и тяжело протекающие ОРВИ, рецидивирующая герпетическая инфекция. 2 пациентки в течение нескольких месяцев лечились по поводу хронического послеродового сепсиса. У одной из них в анамнезе были фурункулез, остеомиелит ногтевой фаланги как осложнение панариция, склонность к инфицированию ран.
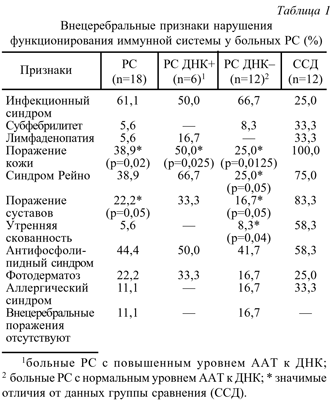
В группе больных ССД инфекционный синдром был выявлен лишь в 25% случаев.
У одной (5,6%) больной PC в анамнезе неоднократные длившиеся по 2-3 недели эпизоды субфебрильной температуры были неясной природы. Одну пациентку дважды с интервалом в несколько лет обследовали по поводу лимфаденопатии, причина которой также осталась неясной.
Лекарственная аллергия в виде крапивницы отмечалась у 2 из 18 больных PC и у трети всех обследованных с ССД. В 38,9% случаев при PC был выявлен синдром Рейно различной локализации и выраженности (в 75% случаев при ССД). Разумеется, природа вазоспастических реакций требует специального исследования. Однако следует указать на нередкое их сочетание с фотодерматозом и ливедо сетчатым, арталгиями и артритами у одних и тех же пациентов.
Фото дерматоз при PC (22,2%) имел примерно ту же частоту, что и при ССД (25% случаев).
У 4 пациентов с PC были артралгии или перенесенный в анамнезе моно- или олигоартрит. Одну больную беспокоила утренняя скованность в суставах и мышцах. Таким образом, поражения суставов при PC были выявлены у 22,2% пациентов (при ССД - у 83,3%).
Различные сочетания клинических симптомов, расцененные нами как стертые проявления антифосфолипидного синдрома (синдром Рейно, ливедо сетчатое, артериальная гипертония, синячковость, кровоточивость десен без признаков гингивита, носовые кровотечения при отсутствии ЛОР-патологии, характерная акушерская патология) были выявлены у 44,4% больных PC и у 58,3% больных ССД.
Довольно часто (38,9%) у больных PC обнаруживались очаговые поражения кожи, напоминавшие таковые при ССД [3]. У одной пациентки, наблюдавшейся с диагнозом "Рассеянный склероз, цереброспинальная форма, благоприятное течение, I стадия, обострение," в результате клинического, лабораторного, патогистологического, инструментального, иммунологического обследований подтвердился диагноз "Системная склеродермия, хроническое течение, стадия II с поражением кожи, легких, ЖКТ, синдромом Рейно, антифосфолипидным синдромом, активность I". У 2 пациентов с PC клинических признаков, характерных для аутоиммунной патологии и иммунологической недостаточности не обнаружено.
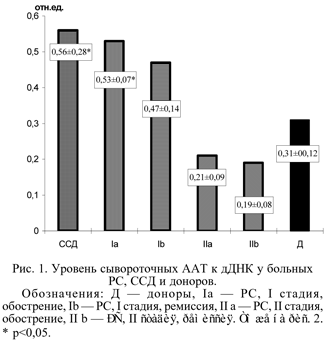
Содержание ААТ к нативной и денатурированной ДНК в сыворотке больных PC оценивали с учетом фазы и стадии заболевания. У 4 из 5 пациентов с I стадией PC в периоде обострения уровень ААТ к денатурированной ДНК (дДНК) превышал аналогичный показатель у их сверстников-доноров. Средние значения ААТ к дДНК в этой группе достоверно отличались от таковых у здоровых - соответственно 0,53±0,07 отн.ед и 0,31±0,12 отн.ед. (рис.1). В периоде ремиссии у 4 из 6 пациентов с I стадией PC содержание этих антител также превышало контрольные показатели. Сравнение средних значений в этой группе с таковыми у доноров неправомочно из-за неоднородности групп по возрасту и полу, однако при обработке по критерию Вилкоксона выявилось достоверное увеличение уровня ААТ к дДНК при стихании патологического процесса.
Содержание ААТ к нативной ДНК (нДНК) в I стадии PC в периоде обострения у всех 6 больных было повышено (рис.2). Средний уровень ААТ к нДНК (0,52±0,08 отн.ед) в этой группе достоверно превышал показатель здоровых добровольцев (0,19±0,09 отн.ед.). В периоде ремиссии повышенный уровень ААТ к нДНК сохранялся у 5 из 6 человек. Разница в группах больных и доноров была также достоверна при обработке по критерию Вилкоксона.
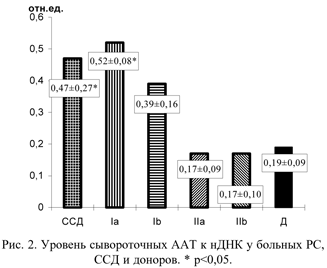
Таким образом, в I стадии PC обнаружились повышение содержания сывороточных ААТ как к нДНК, так и к дДНК, причем существенных различий в разные фазы патологического процесса не отмечено. Поскольку при клиническом обследовании больных PC у большинства из них выявлялись те или иные симптомы, близкие к таковым при ССД, определенный интерес представляло сравнение изучавшихся показателей при этих заболеваниях. У 8 из 12 пациенток с ССД определялись повышенные уровни ААТ к нДНК и дДНК. При сравнении двух групп больных оказалось, что при I стадии PC в периоде обострения содержание ААТ к нДНК (0,52±0,08 отн.ед.) было соизмеримо с таковым при ССД (0,47±0,27 отн.ед.). Аналогичные результаты получены при исследовании уровня ААТ к дДНК (0,53±0,07 отн.ед. при PC и 0,56±0,28 отн.ед. при ССД).
Во II стадии PC содержание ААТ к нДНК и дДНК не отличалось от такового у здоровых доноров. Тем не менее у 4 из 22 больных с обострением заболевания выявлены высокие уровни ААТ к нДНК и у одного пациента - к дДНК.
Нами проведено сравнение частоты встречаемости клинических признаков дисфункции системы у больных PC в зависимости от содержания сывороточных ААТ к ДНК (табл.1). Статистическую значимость результатов оценивали с помощью критерия сопряженности для малых выборок. Из 18 обследованных у 6 пациентов с PC выявлены повышенные уровни ААТ к ДНК, причем у 5 больных с I стадией PC как к дДНК, так и к нДНК. У одного пациента со II стадией заболевания в периоде обострения обнаружено увеличение уровня ААТ только к нДНК.
У всех 6 больных PC с повышенными уровнями ААТ к ДНК выявлены симптомы, характерные для аутоиммунных заболеваний соединительной ткани. При этом синдром Рейно в этой группе наблюдался в 2,7 раза чаще, чем у пациентов с нормальными значениями ААТ к ДНК. В 2 раза чаще отмечались поражения кожи и суставов, фотодерматоз. Только инфекционный синдром с несколько большей частотой наблюдался у больных с нормальным содержанием ААТ к ДНК, а аллергического синдрома не было ни у одного из 6 пациентов с повышенным уровнем ААТ к ДНК.
При оценке клинических признаков аутоиммунной патологии у больных PC по сравнению с группой ССД статистически значимо различались только такие симптомы, как поражение кожи и суставов, синдром Рейно.
Таким образом, у 88,9% больных PC обнаружены клинические симптомы, патогномоничные для заболеваний, в основе которых может лежать дисфункция иммунной системы. Примечательно, что у всех больных эти признаки появились задолго до развития PC. Клиника внецеребральных симптомов близка к таковой при ССД. Клинические и лабораторные признаки PC сближали его с аутоиммунными заболеваниями соединительной ткани, в частности с ССД. Представляется интересным тот факт, что повышенные уровни ААТ к ДНК выявлялись лишь на первых этапах развития заболевания. Возможно, полученные нами данные свидетельствуют об общности этиологии и патогенеза PC и аутоиммунных заболеваний соединительной ткани на ранних этапах их возникновения и о расхождении путей их развития в дальнейшем.
Работа поддержана грантом РФФИ (№00-04-48224).
Литература
1. Барановский А.Г., Канышкова Т.Г., Могельницкий А.С. и др. // Биохимия. - 1998. - 63 (11) - С.1459-1469.
2. Матвеева Т.В., Арлеевская М.И., Демин Т.В // Неврол. вести. - 1998. - № 3-4. - С.60-64.
3. Насонова В.А., Бунчук Н.В. Ревматические болезни. - М, 1997.
4. Cammapoea Л.И., Гафиятуллина Л.А., Аглиуллина Д.Г., Винтер В.Г. // Биотехнология.- 1994.-№ 11-12.-С.38-41.
5. Allinquant В., Schuller E // Pathol. Biol. (Paris) - 1987. - Vol. 35 (3). - P.291-298.
6. Kira J., Goto I. // J. Neurol. Neurosurg Psychiatry. - 1994.- Vol. 57(9).-P.1124-1125.
7. Poser CM., Party D. W., Scheinberg L. et al. // Ann. Neurol. - 1983. - Vol. 13 (2). - Vol. 227-231.
8. Williamson R.A., Burgoon M.P., Owens G.P. et al. // Proc. Natl. Acad. Sci. USA. - 2001. Vol 98 (4).-P.1793-1798.
Султанова И.В., Коликова Ю.О., Ишмухаметова Д.Г., Матвеева Т.В., Арлеевская М.И. Клинические и иммуно-логические признаки диффузных заболеваний соединительной ткани у больных рассеянным склерозом // Неврологический вестник. - 2003. - Т. XXXV, вып. 1-2. - С.18-21.



