Роль рецепторов АТФ (Р2-рецепторов) в нервной системе
Зиганшин А.У.
Казанский государственный медицинский университет
Введение. Широко признано, что основными нейромедиаторами периферической нервной системы являются норадреналин и ацетилхолин. Однако в 60-70-е года XX века стали накапливаться сведения о том, что в автономной (вегетативной) нервной системе, иннервирующей внутренние органы, регистрируются сократительные и расслабляющие ответы, не угнетающиеся блокаторами адрено- и холинорецепторов. Естественно возникло предположение, что эти ответы опосредуются какими-то иными рецепторами, возбуждаемыми неизвестным нейромедиатором. Поскольку природа этого нейромедиатора долгое время оставалась неизвестной, он именовался просто неадрено-, нехолинергический медиатор и соответственно неадрено-, нехолинергические нервы и неадрено-, нехолинорецепторы. На роль этого неизвестного нового нейромедиатора претендентов было очень много - гистамин, серотонин, простагландины, ряд аминокислот и пептидов, однако большинство из них вскоре было отвергнуто.
В 1972 г. Burnstock опубликовал обзор, теперь уже ставший классическим, в котором привел многочисленные факты, в пользу того, что наиболее вероятным претендентом на роль нейромедиатора в тех самых неадрено-, нехолинергических нервах является аденозинтрифосфорная кислота (АТФ) [6].
Он привел убедительные доказательства того, что именно этот хорошо известный пуриновый нуклеотид наилучшим образом соответствует всем критериям, установленным для нейромедиатора, и предложил называть нервы, выделяющие АТФ, пуринергическими, а рецепторы, на которые он действует, - пуринорецепторами.
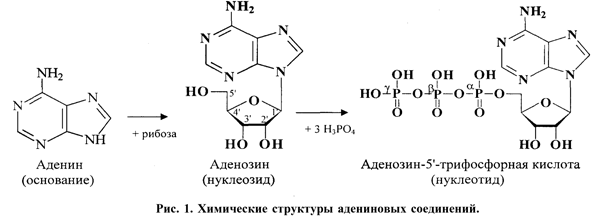
Краткий экскурс в биохимию и физиологию пуринов. Пуриновые соединения синтезируется в организме в результате сложного многостадийного процесса с участием рибозо-5-фосфата, глутамина, аспартата и некоторых других промежуточных продуктов. Важнейшими пуриновыми основаниями являются аденин, гуанин, ксантин и гипоксантин, из которых последние два в большинстве случаев являются лишь продуктами промежуточного синтеза (или распада) первых двух. Присоединение к ядру пуриновых оснований рибозы приводит к образованию нуклеозидов - аденозина и гуанозина. Фосфорилирование гидроксильной группы рибозы в положение 5' (то есть присоединение остатков фосфорной кислоты) ведет к образованию соответствующих нуклеотидов (рис. 1). Наиболее распространенные адениновые нуклеотиды - это аденозин-5'-монофосфорная кислота (адениловая кислота, аденозинмонофосфат, АМФ), аденозин-5'-дифосфорная кислота (аденозиндифосфат, АДФ) и аденозин-5'-трифосфорная кислота (аденозинтрифосфат, АТФ), имеющие соответственно один, два и три остатка фосфорной кислоты, присоединенных последовательно к рибозе в положение 5'. Описаны природные пуриновые нуклеотиды, имеющие более трех фосфорных остатков, а также содержащие два пуриновых ядра, соединенные фосфатной цепочкой (динуклеотиды), однако в физиологических условиях концентрация их в тканях существенно ниже аденозинмоно-, -ди- и -трифосфата.
 |
Фосфатные остатки в структуре нуклеотидов соединены друг с другом так называемой макроэргической связью, поскольку при гидролизе этой связи высвобождается около 7 кКал потенциальной энергии. Поэтому АТФ, имеющая три подобные макроэргические связи, рассматривается как аккумулятор энергии, образующейся в клетке в результате различных биохимических процессов. В физиологических условиях в результате диссоциации и отщепления атома водорода от гидроксильных радикалов остатков фосфорной кислоты молекула нуклеотидов (особенно АТФ) приобретает значительный электрический заряд и, следовательно, клеточная стенка становится для них непреодолимой преградой. Поэтому существует высокая разница между концентрациями адениновых нуклеотидов внутри и вне клетки, доходящая до 1000 раз в пользу внутриклеточных нуклеотидов.
Исходя из этого, долгое время считалось аксиомой, что физиологическое и биохимическое значение пуриновых нуклеотидов ограничивается внутренней средой клетки, а какие-либо внеклеточные эффекты АТФ являются чистой казуистикой. Однако уже в 30-е годы прошлого столетия было показано, что пуриновые нуклеотиды обладают выраженной фармакологической активностью как при введении в организм, так и при контакте с изолированными тканями [22], то есть АТФ и другие нуклеотиды проявляли свой эффект, находясь снаружи клетки. Во второй половине XX века накопилось очень много сведений о разнообразных эффектах внеклеточной АТФ, на основании чего Burnstock сформулировал свою гипотезу о пуринорецепторах [6], которая в настоящее время получила убедительное подтверждение.
Классификация пуринорецепторов. В 1978 году Burnstock предложил первую классификацию пуринорецепторов [8], согласно которой он выделил Р1-пуринорецепторы, основным эндогенным лигандом которых является аденозин, и Р2-пуринорецепторы - соответственно АТФ. В последующем эту классификацию углубили, расширили, дополнили, каждый из типов разделили на несколько подтипов [2, 33, 34]. В настоящее время в соответствии с рекомендациями Номенклатурного Комитета Международного общества фармакологов классификация пуринорецепторов выглядит следующим образом (рис. 2).
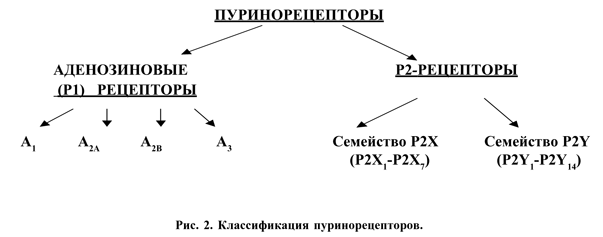 |
Таким образом, в соответствии с современной классификацией из названия рецепторов для АТФ убрали слово «пурино», поскольку было установлено, что на некоторые подтипы Р2- рецепторов оказывают влияние не только пуриновые, но и пиримидиновые нуклеотиды, например уридинтрифосфат или уридиндифосфат. В каждом из семейств Р2-рецепторов выделяют несколько подтипов, обозначаемых соответствующими цифрами, которые присваиваются лишь после того, как определена молекулярная структура рецептора и проведено его генетическое воспроизводство (клонирование). На сегодняшний день в номенклатуру рецепторов внесено 7 подтипов Р2Х рецепторов и 8 подтипов P2Y рецепторов.
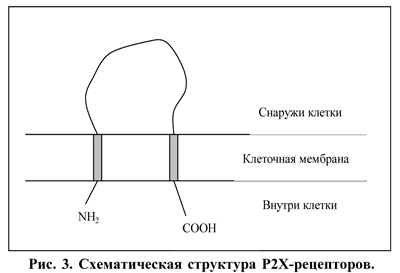
Структура и краткая характеристика Р2-рецепторов. По механизму действия рецепторы семейства Р2Х являются лиганд-оперирующими ионными каналами, регулирующими вход ионов Na+, K+ и Са2+ и, возможно, хлора. Большая часть молекулы этого белка находится внеклеточно, образуя большую петлю, при этом оба концевых фрагмента располагаются внутри клетки (рис. 3).
Различия подтипов рецепторов в основном отражаются в длине С-концевого фрагмента молекулы белка [23]. В 90-х годах ушедшего века была расшифрована структура основных подтипов этих рецепторов и проведено их клонирование [33].
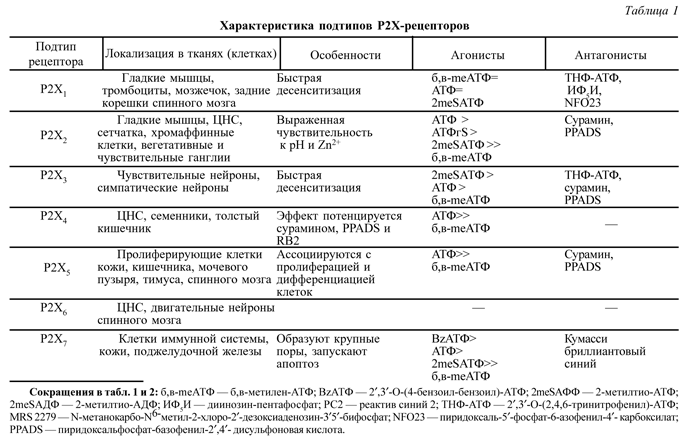
В табл. 1 приведена краткая характеристика рецепторов семейства Р2Х.
Первый подтип Р2Х-рецепторов широко представлен во всех гладкомышечных органах (мочевой пузырь, семявыносящий проток, кишечник, многие кровеносные сосуды). Стимуляция этих рецепторов ведет к выраженной сократительной реакции этих органов, а блокада - угнетает способность к сократительному ответу [14]. Особенностью этих рецепторов является их выраженная способность к десенситизации, то есть к утрате чувствительности к агонисту при длительном контакте с ним. Например, энзиматически устойчивый синтетический аналог АТФ - α,β-метилен-АТФ - служит селективным агонистом P2X1 рецепторов, вызывая быстрый сократительный ответ ткани, на порядок превышающий таковой АТФ. Однако, если не удалить α,β-метилен-АТФ из среды в течение нескольких минут, то последующее добавление любых агонистов Р2Х-рецепторов уже не вызывает никакой ответной реакции.
Имеются убедительные свидетельства о том, что Р2Х3 -рецепторы могут иметь большое значение в проведении болевой чувствительности: методами иммуногистохимии и радиолигандного анализа они обнаружены в периферических окончаниях чувствительных нервов, а также в чувствительных нейронах задних корешков спинного мозга [10,18,38].
Р2Х7 подтип рецептора является наиболее крупной молекулой из всех семи известных на сегодняшний день рецепторов в этом семействе. Гомомультимер из двух или трех молекул Р2Х1 -рецептора образует большую (до 4 нм) пору в мембране клетки, проходимую для веществ с молекулярной массой до 900 дальтон. Образование подобных пор отмечено при ишемии, воспалении, аллергической реакции; показано участие Р2Х1 -рецепторов в инициировании механизма апоптоза клеток [42].
Р2У-рецепторы по механизму действия являются типичными G-протеин-опосредуемыми рецепторами. Белок имеет 7 трансмембранных фрагментов и образует по три петли внутриклеточно и внеклеточно (рис. 4).
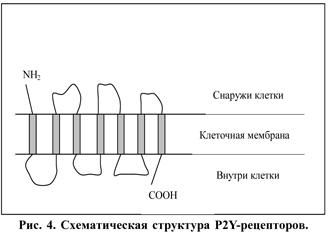 |
Различия между подтипами касаются в основном трансмембранных фрагментов молекулы. В качестве вторичного посредника чаще всего выступает инозитол-трифосфат, образующийся в результате активизации фосфолипазы С, однако активизация фосфолипазы А2 (с соответствующим образованием метаболитов арахидоновой кислоты) и аденилатциклазы (с модулированием уровня цАМФ) также может происходить в ряде случаев при возбуждении Р2У-рецепторов [9, 34]. В этом семействе описано очень много подтипов, и многие из них клонированы. Однако за последние два-три года несколько подтипов Р2У-рецепторов были исключены из классификации вследствие того, что они оказались либо аналогами существующих, либо у клонированных рецепторов не выявили функциональной значимости в тканях человека [34]. Поэтому последовательная нумерация подтипов этих рецепторов на сегодня нарушена.
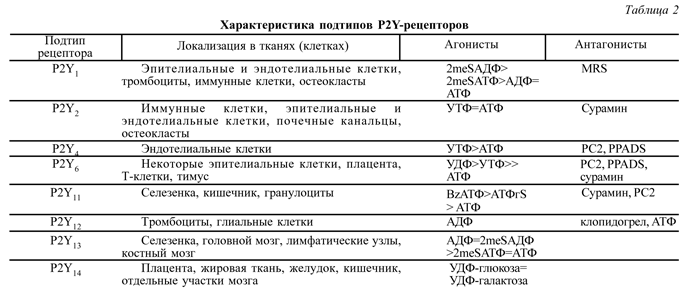
Характеристика подтипов рецепторов указанного семейства приведена в табл. 2.
Здесь обращает на себя внимание последний подтип, получивший номер 12. Особенностью его является то, что АДФ - селективный агонист этих рецепторов, тогда как АТФ - антагонист. Локализуются данные рецепторы исключительно в тромбоцитах, стимуляция их приводит к агрегации тромбоцитов, а блокада предупреждает этот эффект [41].
Ко-трансмиссия. На основе работ классиков физиологии начала XX века установилось и закрепилось мнение, что постганглионарные окончания симпатической нервной системы выделяют исключительно норадреналин в качестве медиатора, тогда как ацетилхолин - это единственный медиатор, выделяющийся из окончаний постганглионарных парасимпатических нервных волокон. Известен так называемый принцип Дейла (один нерв - один медиатор), который он сам ни в одной из своих статей не сформулировал, но который естественным образом вытекает из его основных фундаментальных работ [21]. Однако в настоящее время стало очевидно, что ко-трансмиссия, то есть одновременное выделение двух или даже целого «коктейля» нейромедиаторов и нейромодуляторов в ответ на нервный импульс, является, скорее, законом, нежели исключением [7]. Установлено, что в состав этого «коктейля» в разных нервных окончаниях могут входить вместе с норадреналином и ацетилхолином также аденозинтрифосфорная кислота (АТФ), оксид азота (NO), аденозин, нейропептид Y (NPY), вазоинтестинальный пептид (VIP), субстанция Р (SP), ГАМК, глютамат и др. Роль большинства этих веществ в функционировании нервной системы описана в многочисленных публикациях последних лет [39], однако о рецепторных эффектах АТФ в процессах передачи нервного импульса известно меньше.
Р2-рецепторы в симпатической нервной системе. Роль Р2-рецепторов в осуществлении симпатического нервного контроля хорошо изучена на примере семявыносящего протока и кровеносных сосудов нескольких видов животных [14]. Известно, что стимуляция электрическим полем (СЭП) вызывает двухфазный сократительный ответ семявыносящего протока кролика: ранний кратковременный фазный ответ угнетается антагонистами Р2-рецепторов, например сурамином или PPADS, а поздний более длительный тонический ответ - альфа-адреноблокаторами, например фентоалмином или празозином.
Таким образом, ранний фазный ответ является пуринергическим, а поздний тонический -адренергическим ответом ткани на раздражение [50]. Инкубация ткани с тетродотоксином, специфическим ингибитором потенциалзависимых натриевых каналов в возбудимых тканях, или гуанетидином, нарушающим высвобождение медиаторов из симпатического нервного окончания, полностью угнетает как фазный, так и тонический ответ семявыносящего протока, что доказывает участие симпатической нервной системы в происхождении этих сокращений [35]. Доказано, что в реализации пуринергического компонента сократительного ответа, опосредуемого симпатической нервной системой, основное значение имеет Р2Х1-рецепторы [5, 53]. Стимуляция этих рецепторов их селективным агонистом α,β-метилен-АТФ приводит к возникновению возбуждающих синаптических потенциалов и к повышению содержания ионов кальция в клетке за счет вначале открытия Р2Х1-рецепторзависимых неселективных каналов, а затем и потенциалзависимых кальциевых каналов L-типа. Повышение уровня внутриклеточного кальция вызывает сократительный ответ.
Соотношение пуринергического и адренергического компонента в симпатическом ответе значительно варьирует в зависимости от иннервируемой ткани. Например, в хвостовой артерии крысы пуринергический компонент составляет примерно 10% [3], в центральной артерии уха кролика - от 20 до 60% [31], а в кишечной артерии кролика достигает 100% [46]. Проведенные нами недавно исследования показали, что пуринергический компонент значительно выражен в артерии желчного пузыря человека и существенно меньше - в подкожной вене бедра человека [1, 60].
Р2-рецепторы в парасимпатической нервной системе. Классическим объектом исследования роли Р2-рецепторов в парасимпатической нервной системе является мочевой пузырь. Как и в семявыносящем протоке, СЭП вызывает двухфазное сокращение мочевого пузыря, однако здесь фазы менее четко отличаются друг от друга. Быстрый первичный пуринергический компонент сменяется, как правило, нерегулярными сократительными ответами, имеющими тенденцию к затуханию (холинергический компонент) [16]. Как и в случае с семявыносящим протоком, тетродотоксин полностью угнетает оба компонента сократительного ответа на СЭП, доказывая их нейрогенное происхождение [17]. Добавление в среду селективного агониста Р2Х1-рецепторов α,β-метилен-АТФ вызывает возбуждающие синаптические потенциалы, которые не угнетаются атропином [26]. Высвобождение АТФ из нервного окончания зависит преимущественно от тока кальция внутрь клетки через Р- и Q-типы кальциевых каналов, тогда как высвобождение ацетилхолина - от функционирования кальциевых каналов N-типа [55].
Пуринергический компонент сократительного ответа мочевого пузыря хорошо выражен у многих подопытных животных, составляя до 25% от общего сократительного ответа ткани [44], но очень незначительно представлен в нормальном мочевом пузыре человека (не более 5%) [4]. Однако ситуация резко изменяется при ряде патологических процессов. Так, например, при интерстициальном цистите сокращение мочевого пузыря, вызванное СЭП, становится пуринергическим более чем на 50%, при этом чувствительность ткани к агонистам Р2Х-рецепторов возрастает в несколько раз [43]. Это позволяет предположить участие Р2Х-рецепторов в патогенезе этого заболевания. В частности, резко повышенный рефлекс на мочеиспускание (типичный симптом у подобных больных) может быть связан с повышением чувствительности детрузора мочевого пузыря к АТФ, выделяющейся из клеток при воспалении.
Интересно отметить, что пуринергический компонент сократительного ответа мочевого пузыря достоверно более выражен у старых крыс по сравнению с молодыми, хотя холинергический компонент таких изменений не претерпевает [47].
Р2-рецепторы в метасимпатической (интрамуральной) нервной системе. Большинство исследователей признают, что в кишечнике, возможно, и в некоторых других органах и тканях, имеется еще один, независимый от симпатической и парасимпатической нервных систем нервный контроль, который разными авторами обозначается по-разному. В отечественной литературе чаще встречается название «метасимпатическая нервная система». Установлено, что стимуляция метасимпатической нервной системы вызывает ингибиторные синаптические неадрено-, нехолинергические потенциалы, которые опосредуют тормозные ответы и соответственно расслабление кишечника [28]. Три основных компонента входят в «коктейль» медиаторов, высвобождающихся из нейронов метасимпатической нервной системы - АТФ, NO и VIP [14]. Соотношение этих компонентов существенно различается как по ходу кишечника, так и у различных животных. В целом считается, что пуринергический компонент более выражен в дистальных отделах кишечника, преимущественно в несфинктерных участках [12].
Р2-рецепторы в афферентной нервной системе. Известно, что внутрикожные или подкожные инъекции АТФ вызывают значительную болевую реакцию как у животных, так и у людей [20, 57]. В последующем в месте инъекции возможно развитие воспалительного процесса, интенсивность которого снижается на фоне антагонистов Р2-рецепторов [57]. В 1995 г. были клонированы Р2Х3-рецепторы и установлено, что местами их преимущественной локализации являются ноцицептивные чувствительные нейроны [18,38]. В последующем Р2Х3-рецепторы (часто в виде гетеромультимеров с Р2Х2-рецепторами) были найдены в чувствительных нервных терминалях кожи, языка, пульпы зуба, суставов, мочевого пузыря, как и в высокоспециализированных нервных клетках глаза, в вестибулярном и слуховом аппарате [10, 11]. Исследования на трансгенных мышах с врожденным отсутствием Р2Х3-рецепторов открыли новую страницу в исследовании физиологической роли этих рецепторов, в частности было установлено, что у подобных мышей нарушен рефлекс на мочеиспускание [19].
Недавно Burnstock выдвинул новую гипотезу относительно роли Р2Х-рецепторов в ноцицептивной системе [11]. Согласно этой теории, что растяжение трубчатых или мешотчатых органов (кишечник, мочеточник, мочевой пузырь, желчный пузырь) ведет к высвобождению из эпителиальных клеток этих органов АТФ, которая воздействуя на субэпителиальные чувствительные нервные сплетения стимулирует Р2Х3-рецепторы. В зависимости от силы этого растяжения ответная реакция может быть в виде местной рефлекторной стимуляции мышечных элементов органа для обеспечения перистальтики или опорожнения (при слабых или умеренных растяжениях) или передача импульса в вышестоящие структуры с достижением центров боли в ЦНС (при сильных растяжениях). Эту гипотезу еще следует доказать, однако уже есть свидетельства, что высвобождение АТФ из клеток эпителия мочевого пузыря происходит в ответ на растяжение [54], а наличие Р2Х3-рецепторов установлено было в этих клетках ранее [37].
Р2-рецепторы в соматической нервной системе. АТФ выделяется совместно с ацетилхолином из мотонейронов соматической нервной системы, при этом продукт его распада аденозин оказывает пресинаптическое модулирующее влияние на выброс ацетилхолина, тогда как АТФ, обладая собственным подобным пресинаптическим действием, оказывает еще и постсинаптическое потенцирующее влияние на эффект ацетилхолина на никотиновые рецепторы [49, 51]. Недавно было установлено, что пресинаптическое угнетающее действие АТФ на выброс ацетилхолина в нервно-мышечном синапсе осуществляется посредством метаботропных P2Y-рецепторов [51]. Депрессивный эффект АТФ, как и аденозина, Са+2-зависим [27], но в отличие от него имеет выраженную температурную зависимость - гипотермия значительно усиливает действие АТФ [59]. Последнее является, видимо, характерной особенностью Р2-рецептор-опосредованной передачи, поскольку ранее аналогичный эффект был нами показан в экспериментах на гладкомышечных органах [61].
Р2-рецепторы в центральной нервной системе. Влияние аденозина на ЦНС в физиологических и патофизиологических условиях изучено довольно подробно [24, 40]. Однако исследованию возможной роли АТФ в ЦНС до последнего времени уделялось меньшее внимание. Между тем в экспериментах с меченым аденозином установлено, что он после попадания в нервную клетку идет в основном на синтез нуклеотидов (преимущественно АТФ), которые по аксонам транспортируются к нервным окончаниям [48]. Концентрация АТФ может доходить до 2 тМ в коре и 4 тМ в гипокампе [36], а выделение АТФ в ответ на стимуляцию было показано в синаптосомах коры, гипокампа, мозжечка и некоторых других структур головного мозга [45, 52]. Установлено, что АТФ способна высвобождаться из синаптосом совместно с ацетилхолином, катехоламинами, ГАМК, глютаматом [15].
Наличие различных подтипов Р2Х- и P2Y-рецепторов в ЦНС было показано многими исследователями [15], однако широкое разнообразие и выраженная видоспецифичность распространенности этих рецепторов в различных отделах головного мозга не позволяют пока точно определить их роль в проявлении поведенческих реакций или иных функций ЦНС. Недавно установлено, что АТФ может высвобождаться не только из нейронов, но и из глиальных клеток, а Р2-рецепторы имеются и на их поверхности [25, 30], что предполагает возможность не только кратковременных, но и долговременных (трофических) нейронально-глиальных взаимодействий.
Прекращение действия внеклеточной АТФ. Попав во внеклеточное пространство, АТФ очень быстро разрушается путем последовательного дефосфорилирования (отщепления остатков фосфорной кислоты) до аденозина, для которого существует механизм обратного захвата в нервную клетку. Распад АТФ осуществляют особые ферменты, локализующиеся на внешней поверхности мембраны клеток и поэтому обозначаемые добавлением приставки «экто» - экто-АТФаза, экто-АТФ/АДФ-дифосфогидролаза и т.д. [58]. Количество и активность экто-ферментов, участвующих в распаде АТФ, могут быть различными в разных тканях, поэтому в настоящее время их принято объединять термином «экто-нуклеотидазы» [62]. В последние годы было установлено, что вместе с мембраносвязанными экто-нуклеотидазами в расщеплении АТФ участвуют и «растворимые нуклеотидазы», которые высвобождаются из нервного окончания вместе с медиатором [32] - это принципиально новый механизм инактивации нейромедиатора, не описанный ранее ни для одного из признанных на сегодня веществ такого действия.
Перспективы клинического применения веществ, влияющих на Р2-рецепторы. Обширная литература последних лет свидетельствует о том, что Р2-рецепторы имеются практически во всех органах и тканях животных, которые подвергались исследованию, поэтому вполне логично предположить, что они также широко представлены в организме человека. Действительно, те немногочисленные пока исследования тканей человека подтверждают наличие в них Р2-рецепторопосредованных ответов, что представляет большой интерес с практической точки зрения, определяя Р2-рецепторы как мишень для новых лекарственных препаратов, имеющих принципиально отличный от известных механизм действия. Первой ласточкой на фармацевтическом рынке из этой новой области явился препарат клопидогрел - новый эффективный антиагрегант, применяемый при стенокардии для профилактики инфаркта миокарда [29]. Механизм действия клопидогрела заключается в угнетении Р2У12-рецепторов на тромбоцитах, что делает невозможной их агрегацию друг с другом и соответственно предупреждает развитие тромбоза.
Имеется большое число исследований, посвященных возможному применению агонистов и антагонистов Р2-рецепторов в клинике нервных болезней, в частности при инсультах, нейродегенеративных заболеваниях (болезнь Альцгеймера и болезнь Паркинсона), болевом синдроме, при нарушениях зрения и слуха [13,56]. Перспективными направлениями вероятного клинического применения препаратов пуринергического механизма действия также являются заболевания сердечно-сосудистой и дыхательной систем, диабет, остеопороз, воспалительные и опухолевые процессы, нарушения эректильной функции. Поскольку многие фармацевтические фирмы включились в настоящее время в разработку пуринергических препаратов, можно ожидать появления на рынке новых подобных лекарственных средств уже в самое ближайшее время.
Литература
1. Зиганшин А.У., Зиганшин Б.А., Гиниятова Л.Р., Джорджикия Р.К. // Бюлл. эксп. биол. мед. - 2004. - Т. 137, №3. -С. 321-324.
2. Abbracchio M.P., Burnstock G. // Pharmacol.Ther.- 1994.-Vol.64.- P.445-475.
3. Bao J.X. // Acta Physiol. Scand. - 1993. - Suppl. 610.- P. 1-58.
4. Bayliss M., Wu C., Newgreen D. et al. // J. Urol. - 1999. - Vol. 162.- P. 1833-1839.
J. Bo X., Sexton A., Xiang Z. et al. // Eur. J. Pharmacol. - 1998. - Vol. 353. - P. 59-65.
6. Burnstock G. // Pharmacol. Rev. - 1972. - Vol. 24. - P. 509-581.
7. Burnstock G. // Neuroscience. - 1976. - Vol. 1. - P. 239-248.
8. Burnstock G. // Cell Membrane Receptors for Drugs and Hormones: A multidisciplinary Approach / Eds. R.W.Straub, L.Bolis.- N.-Y.: Raven Press, 1978.- P.107-118.
9. Burnstock G. // Progr. Brain Res. - 1999. - Vol. 120. - P. 3-10.
10. Burnstock G. // Br. J. Anaesth. - 2000. -Vol.84. - P. 476-488.
11. Burnstock G. // Trends Pharm. Sci. - 2001. - Vol. 22. - P. 182-188.
12. Burnstock G. // Handbook of Experimental Pharmacology, Vol. 151 (I). Purinergic and Pyrimidinergic Signaling / Eds. M.P. Abbracchio M.P., Williams M. - Berlin: Springer, 2001. - P.141-238.
13. Burnstock G. // Clin. Med. - 2002. - Vol. 2. - P. 45-53.
14. Burnstock G. // Curr. Top. Membr. - 2003. - Vol. 54. - P. 1-27.
15. Burnstock G. // Curr. Top. Membr. - 2003. - Vol. 54. - P. 307-368.
16. Burnstock G., Cocks Т., Crowe R., Kazakov L. // Br. J. Pharmacol. -1978. -Vol. 63. -P.125-138.
17. Burnstock G., Cocks Т., Kazakov L, Wong H.K. // Eur. J. Pharmacol.-1978.-Vol. 49. -P. 145-149.
18. Chen C.C., Akopian A.N., Sivilotti L. et al. // Nature. - 1995. - Vol. 377. - P. 428-431.
19. Cockayne D.A., Hamilton S.G., Zhu Q.M. et al. // Nature. - 2000.- Vol. 407.- P. 1011-1015.
20. Coutts A.A., Jorizzo J.L., Eady R.A.J. et al. // Eur. J. Pharmacol. - 1981. - Vol. 76. - P. 391-401.
21. Dale H.H. // Proc. Roy. Soc. Med. - 1935. - Vol. 28. - P. 319-322.
22. Drury A.N., Szent-Gyxrgyi A. // J. Physiol. - 1929. - Vol. 68.- P. 213-237.
23. Dunn P.M., Zhong Y., Burnstock G. // Prog. Neurobiol. - 2001. - Vol. 65.- P. 107-134.
24. Feoktistov L, Biaggioni L // Pharmacol. Rev. - 1997. - Vol. 49. - P. 381-402.
25. Fields R.D., Stevens B. // Trends NeuroscL - 2000. - Vol. 23. -P. 625-633.
26. Fujii K. // J. Physiol. -1988. -Vol. 404. -P.39-52.
27. Grishin S., Shakirzyanova A., Giniatullin A. et al. // Eur. J. Neurosci. - 2005. - Vol. 21. - P. 1271-1279.
28. Hoyle C.H.V. // Sem. Neurosci. - 1996. - Vol. 8. - P. 207-215.
29. Jarvis В., Simpson K. // Drugs. - 2000. - Vol. 60. - P. 347-377.
30. John G.R., Simpson J.E., Woodroofe M.N. et al. // J. Neurosci. - 2001. - Vol. 21. - P. 4134-4142.
31. Kennedy C., Saville V., Burnstock G. // Eur. J. Pharmacol. - 1986. - Vol. 122. - P. 291-300.
32. Kennedy C., Todorov L.D., Sneddon P. // Trends Pharmacol. Sci. - 1997. - Vol. 18. - P. 263-266.
33. Khakh B.S., Barnard E.A., Burnstock G. et al. // The IUPHAR Compendium of Receptor Characterization and Classification. - London : IUPHAR Media, 2001. - P.290-305.
34. KingB.F., Burnstock G., BoyerJ.L. et al // The IUPHAR Compendium of Receptor Characterization and Classification. - London : IUPHAR Media, 2001. - P.306-320.
35. Kirkpatrick К., Burnstock G. // Eur. J. Pharmacol. - 1987. - Vol. 138. - P. 207-214.
36. Kogure K., Alonso O.F. // Brain Res. - 1978. - Vol. 154.-P. 273-284.
37. Lee H.-Y., Bardini M., Burnstock G. // J. Urol. - 2000. - Vol. 163. - P. 2002-2007.
38. Lewis C., Neidhart S., Holy C. et al. // Nature. - 1995. - Vol. 377. - P. 432-435.
39. LundbergJ.M. // Pharmacol. Rev. - 1996. - Vol.48. - P. 113-178.
40. Masino S.A., Dunwidde T.V. // Handbook of Experimental Pharmacology, Vol. 151 (I). Purinergic and Pyrimidinergic Signaling / Eds. M.P. Abbracchio M.P., Williams M. - Berlin: Springer, 2001. - P.251-288.
41. Mills D.C.B. // Thromb. Haemostas. - 1996. - Vol. 76. - P. 835-856.
42. North R.A., Suprenant A. // Ann. Rev. Pharmacol. Toxicol. - 2000. - Vol. 40. - P.563-580.
43. Palea S., Artibani W., Ostardo E. et al. // J. Urol. - 1993. - Vol. 150. - P. 2007-2012.
44. Parson S.M., Prior C., Marshall I.G. // Int. Rev. Neurobiol. - 1993. - Vol. 35. - P. 279-390.
45. Potter P., White Т.О. // Neuroscience. - 1980. - Vol. 5. - P. 1351-1356.
46. Ramme D., Regenold J.T., Starke K. et al. // Naunyn Schmiedeberg's Arch. Pharmacol. - 1987. - Vol. 336. - P. 267-273.
47. SaitoM., Gotoh K., Kondu A. // Urol. Int. - 1991. - Vol. 47 (Suppl. 1) - P. 39-42.
48. Schubert P., Lee K., West M. et al. // Nature. - 1976. - Vol. 260.-P. 541-542.
49. Silinsky E.M., Redman R.S. // J. Physiol. (bond.) - 1996. - Vol. 492.-P. 815-822.
50 Sneddon P., McLaren G.J., Kennedy C. // Sem. Neurosci. - 1996. - Vol. 8. - P. 201-206.
51. Sokolova E., Grishin S., Shakirzyanova A. et al. // Eur.J.Neurosci.-2003.-Vol.18.- P. 1254-1264.
52. Sperlagh В., Sershen H., Lajtha A., Vizi E.S. // Neuroscience. - 1998. - Vol. 82. - P. 511-520.
53. Valera S., Hussy N., Evans R.J. et al. // Nature. - 1994. - Vol. 371. -P. 519-523.
54. Vlaskovska M., Kasakov L., Rang W. et al. // J. Neurosci. - 2001. - Vol. 21. - P. 5670-5677.
55. Waterman S. // J. Neurosci. -1996. -Vol. 16. - P.4155-4161.
56. Williams M. Developments in P2 receptor targeted therapeutics // Prog. Brain Res. - 1999. -Vol. 120. - P. 93-96.
57. Ziganshina L.E., Ziganshin A.U., Hoyle C.H.V. et al. // Inflamm.Res.- 1996.- Vol.45.- P. 96-102.
58. Ziganshin A.U., Hoyle C.H. V., Burnstock G. // Drug Dev. Res. - 1994. - Vol.32. - P.134-146.
59. Ziganshin A. U., Kamaliev R.R., Grishin S.N. et al. // Eur. J. Pharmacol. - 2005. - Vol. 509. - P. 187-193.
60. Ziganshin A. U., Khaziakhmetov D.F., Ziganshina L.E. et al. // Vase. Pharmacol. - 2004. - Vol. 46, N 1. - P. 17-21.
61. Ziganshin A.U., Rychkov A.V., Ziganshina L.E., Burnstock G. // Eur. J. Pharmacol. - 2002. - Vol. 456. - P. 107-114.
62. Zimmermann H., Braun N. /I Prog. Brain Res. - 1999. - P. 371-385.
Зиганшин А.У. Роль рецепторов АТФ (Р2-рецепторов) в нервной системе // Неврологический вестник. - 2005. - Т. XXXVII, вып. 1-2. - С.45-53.